Pro zvládnutí jednoduchého anorganického názvosloví byste měli znát:
- Názvoslovné předpony (ný-, natý-, itý-, ičitý-, ičný-/ečný-, ový-, istý-, ičelý-)
- Názvy prvků
- Co znamená oxidační číslo
Oxidační číslo
Vytvořil JMaker, 3.1.2022
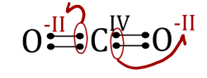 Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Křížové pravidlo
Při tvorbě vzorců oxidů lze použít tzv. křížové pravidlo. Postup je následující:
- Napíše se oxidační čísla nad jednotlivé prvky, nad kyslík -II a nad druhý prvek číslo podle názvoslovné přípony
- Křížově se pod druhý prvek napíše stejné číslo arabskou číslicí, tato čísla se obě píší kladná!
- Pokud lze arabská čísla krátit, zkrátí se
- Jedničky se do konečného vzorce nepíší
Oxidy O-II
 Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Například výpočet oxidačního čísla pro Al2-IIIO3-II - je: 2*3 + 3*-2 = 0
Příklady oxidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 2:1 | K2O - oxid draselný |
| II | 1:1 | CaO - oxid vápenatý |
| III | 2:3 | Al2O3 - oxid hlinitý |
| IV | 1:2 | PbO2 - oxid olovičitý |
| V | 2:5 | I2O5 - oxid jodičný |
| VI | 1:3 | SO3 - oxid sírový |
| VII | 2:7 | Mn2O7 - oxid manganistý |
| VIII | 1:4 | XeO4 - oxid xenoničelý |
Sulfidy S-II
Sulfidy jsou dvouprvkové sloučeniny síry s elektropozitivnějším prvkem. Jelikož má síra v sulfidech stejné oxidační číslo jako kyslík v oxidech, tvoří se jejich názvy a vzorce obdobným způsobem. Ve starší literatuře se můžou být sulfidy pojmenovány výrazem sirníky.
Příklady sulfidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 2:1 | Na2O - sulfid sodný |
| II | 1:1 | PbS - sulfid olovnatý |
| III | 2:3 | In2O3 - sulfid inditý |
| IV | 1:2 | CS2 - sulfid uhličitý |
| V | 2:5 | P2S5 - sulfid fosforečný |
| VI | 1:3 | MoS3 - sulfid molybdenový |
| VII | 2:7 | Re2S7 - sulfid rhenistý |
| VIII | 1:4 | OsS4 - sulfid osmičelý |
Halogenidy X-I
Halogenidy jsou dvouprvkové sloučeniny halogenů (flouru, chloru, jódu, bromu) s elektropozitivnějšími prvky, též se jedná o soli halogenvodíkových kyselin. Jedná se tedy o fluoridy, chloridy, jodidy a bromidy. Oxidační číslo halogenu je vždy -I, oxidační stav elektropozitivnějšího prvku v halogenu tedy přímo odpovídá názvoslové příponě.
Příklady halogenidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 1:1 | NaCl - chlorid sodný |
| II | 1:2 | CaF2 - fluorid vápenatý |
| III | 1:3 | AlI3 - jodid hlinitý |
| IV | 1:4 | SiBr4 - bromid křemičitý |
| V | 1:5 | PCl5 - chlorid fodforečný |
| VI | 1:6 | SF6 - fluorid sírový |
| VII | 1:7 | MnCl7 - chlorid manganistý |
| VIII | Není znám |
Hydroxidy (OH) -I
Hydroxidy jsou tříprkové sloučeniny, kdy jako aniont vystupuje skupina (OH)-I. Formálně vznikají odtržením jednoho atomu vodíku od vody. Maximální oxidační číslo třetího atomu (kationtu) je v hydroxide rovno čtyrem. Dříve se označovaly jako louhy.
Hydridy H -I
Hydridy jsou dvouprkové sloučeniny vodíku. Jsou to jediné významné sloučeniny, ve kterých se vodík většinou vyskytuje v oxidačním stavu -I (většinou se vodík vyskytuje v oxidačním stavu +I). Lze je rozdělit na dvě hlavní skupiny: Iontové hydridy a kovalentní hydridy.
Iontové hydridy
Iontoé hydridy jsou sloučeninami vodíku
s elektropozitivními prvky (zpravidla alkalickými kovy a kovy alkalických zemin. Název se skládá ze dvou slov, prvním je podstatné jméno hydrid a druhým je přídavné jméno s příslušnou názvoslovnou příponou. Z povahy prvků I. a II. A skupiny se tyto vyskytují jen v oxidačních stavech +I a +II.
Příklady hydridů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 1:1 | KH - hydrid draselný |
| II | 1:2 | MgH2 - hydrid hořečnatý |
Kovalentní hydridy
Kovalentní hydridy, někdy také označované jakou sloučeniny vodíku s prvky III. až VII. A skupiny. Vodík se může vyskytovat v oxidačním stavu -I i +I, vždy záleží na elektronegavitě druhého prvu (když má menší hodnotu je vodík v oxidačním stavu +I). Názvy těchto hydridů se tvoří z kořenu latinského názvu druhého prvku a přípony -an, viz tabulka níže.
Příklady názvů kovalentních hydridů
| Vzorec | Latinský název prvku | Název kovalentího hydridu |
| BH3 | Bor-um | boran |
| SiH4 | Sil-icium | silan |
| H2Se | Sel-enium | selan |
| H2Te | Tell-urium | tellan |
Formálně mezi hydridy patří i většina bezkyslíkatých kyselin (jedná se o sloučeniny vodíku s prvky VII. A skupiny). Názvosloví těchto sloučenin se věnujeme o kapitolu níže.
Bezkyslíkaté kyseliny HX
Bezkyslíkaté kyseliny neobsahují kyslík, jedná se o sloučeniny vodíku (s oxidačnímm číslem +I) a alespoň jednoho nekovového prvku. Názvy těchto látek se tvoří z podstatného jména kyselina a přídavného jména vytvořeného z názvu sloučeniny nekovu s vodíkem s koncovkou -ová. Toto platí, jedná-li se o vodné roztoky. Pokud se látka vyskytuje v plynném skupneství, vypouští se podstatné jméno kyselina a připojuje se přípona -ovodík. Tato skutečnost se někdy označuje v závorce za vzorkem: aq (z latinského aqua) se píše k vodným roztokům (kyselinám) a g (z latinského gas) se píše k plynům.
HBr(aq) - kyselina bromovodíková x HBr(g) - bromovodík
Příklady názvů bezkyslíkatých kyselin
| Vzorec | Název |
| HCl(aq) | kyselina chlorovodíková |
| HCl(g) | chlorovodík |
| HI(aq) | kyselina jodovodíková |
| HI(g) | jodovodík |
| HCN(aq) | kyselina kyanovodíková |
| HCN(g) | kyanovodík |
Kyslíkaté kyseliny HIMO-II
Kyslíkaté kyseliny, někdy také oxokyseliny jsou tříprvkové sloučeniny obsahující vodík H(v oxidačním stavu +I), kyselinotvorný prkvem M (s kladným oxidačním číslem) a kyslík (v oxidačním stavu -II). Název se skládá z podstatného jména kyselina a z přídavného jména, které charakterizuje kyselinotvorný prvek. Oxidační číslo kyselinotvorného prvku je vyjádřeno názvoslovnou příponu ný-, natý-, itý-. atd.
Počet vodíků je vyjádřem pomocí řeckých předpod di-, tri-, tetra-, penta- atd.
Kyseliny fosforu a arsenu jsou zpravidla trojsytné, obsahují tedy tři atomy vodíku.
Jedinou výjimkou v pořadí prvků v kyselinách je kyselina fluorná, která se kvůli elektronegativitám fluoru a kyslíku píše HOF a ne HFO.
Příklady kyslíkatých kyselin
| Oxidační stav | Poměr x:y:z HxMyOz | Příklad |
| I | 1:1:1 | HClO - kyselina chlorná |
| III | 1:1:2 | HNO2 - kyselina dusitá |
| IV | 2:1:3 | H2SO3 - kyselina siřičitá |
| V | 1:1:3 | HIO3 - kyselina jodičná |
| VI | 2:1:4 | H2SO4 - kyselina sírová |
| VII | 1:1:4 | HMnO4 - kyselina manganistá |
Soli kyslíkatých kyselin
Soli jsou iontové sloučeniny, které vznikají odtržením vodíků z molekul kyselin. Pokud se od molekuly kyseliny odtrhne pouze část vodíků, vznikají tzv. hydrogensoli.
Názvy solí
Názvy solí se skládají z podstatného jména, které je odvozeno z názvu kyseliny. U názvu kyseliny se zkrátí "á" na konci a přidá se "n". Např. sůl od kyseliny chlorné se nazývá chlornan, sůl od kyseliny dusité se nazývá dusitan. Jedinou výjimkou je sůl odvozené od kyselin v oxidačním stavu VI., např. sůl odvozená od kyseliny sírové není sírovan, ale jen síran.
K podstatnému jménu se přídává přídavné jméno, jehož přípona odpovídá axidačnímu stavu katintu v soli.
Příklady názvů solí kyslíkatých kyselin
| Odvozeno od kyseliny | Název | Vzorec |
| kyselina siřičitá - H2SO3 | siřičitan draselný | K2SO3 |
| kyselina chlorná - HClO | chlornan lithný | LiClO |
| kyselina sírová - H2SO4 | síran sodný | Na2SO4 |
| kyselina manganistá - HMnO4 | manganistan vápenatý | Ca(MnO4)2 |
| kyselina trihydrogenboritá - H3BO3 | boritan zinečnatý | Zn(BO3)2 |
Hydrogensoli
Jak již bylo v úvodu naznačeno, nemusí se vždy odtrhnout od molekuly všechny kyslíky. Pokud se jich odtrhne jen část, mluvíme o hydrogensolích. Např. když se z kyseliny dihydrogenuhličíté H2CO3odtrhne jen jeden vodík, vzniká nám hydrogenuhličitan, ten má vzorec HCO3-. Od kyseliny trihydrogenfosforité mohou vzniknout kromě fosforitanů ještě hydrogensoli hydrogenfosforitany HPO32- (odštěpeny dva vodíky) a dihydrogenfosforitany H2PO3-(odštěpen jen jeden vodík).
 Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
 Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule